Les inhibiteurs de protéines kinases ont révolutionné le traitement du cancer en ciblant spécifiquement les kinases qui interviennent dans la croissance et la survie des tumeurs
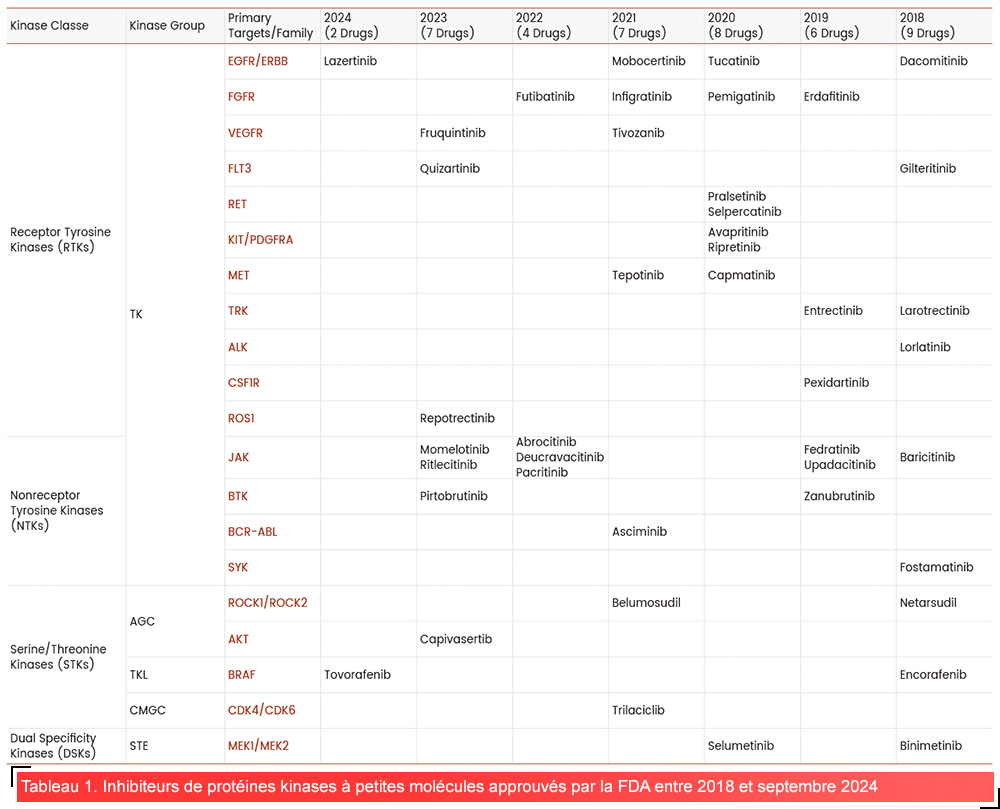
En 2024, plus de 80 inhibiteurs de protéines kinases à petites molécules ont reçu l’approbation de la FDA, le mode d’action de la plupart d’entre eux étant d’inhiber la liaison de l’ATP à la kinase cible1,2. L’efficacité de ces inhibiteurs reste cependant souvent limitée en raison du développement de la résistance, qui résulte principalement des mutations dans le domaine kinase. Pour résoudre ce problème majeur, des inhibiteurs de kinases de nouvelle génération sont en cours de développement afin de surmonter la résistance aux médicaments et améliorer les résultats pour les patients2–4.
Importance des protéines kinases sur les plans physiologique et pathologique
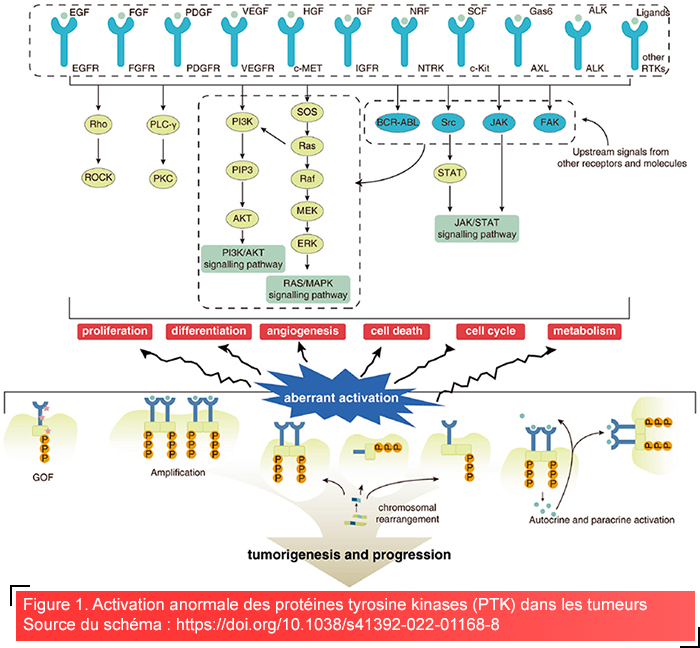
Les protéines kinases sont des enzymes essentielles responsables de la régulation d’une quantité importante de processus cellulaires, en catalysant la phosphorylation des protéines, ce qui implique le transfert du γ-phosphate de l’ATP vers des résidus d’acides aminés spécifiques des substrats protéiques5. La phosphorylation est l’une des modifications post-traductionnelles (PTM) les plus importantes et les plus actives chez les eucaryotes, capable de modifier l’activité biologique de protéines jouant divers rôles dans les cellules. En agissant comme des commutateurs moléculaires dans des réseaux complexes de signaux, les protéines kinases jouent un rôle régulateur important dans pratiquement tous les aspects de la vie cellulaire, notamment lors de la croissance, de la division, du métabolisme, de la transduction des signaux, de l’apoptose et de la différenciation3,5. Sur le plan physiologique, les protéines kinases assurent la bonne progression du cycle cellulaire, l’équilibre métabolique et les réponses cellulaires aux signaux externes, maintenant ainsi l’homéostasie cellulaire globale5. Cependant, la dérégulation des protéines kinases peut conduire à des conditions pathologiques. Par exemple, une activité anormale des kinases est une caractéristique commune de nombreux cancers, où des mutations à l’intérieur du domaine kinase comme l’EGFR et le BRAF entraînent une prolifération et une survie incontrôlée des cellules (figure 1)3,6,7. En outre, le dysfonctionnement des protéines kinases est impliqué dans les maladies cardiovasculaires, les troubles neurodégénératifs et le diabète, ce qui met en lumière leur rôle dans la progression de la maladie8,9.
L’activation et l’inactivation correctes des PTK jouent un rôle crucial dans le bon fonctionnement cellulaire. L’activation anormale des PTK dépend de quatre facteurs principaux : les mutations de gain de fonction, les amplifications génomiques, les fusions de gènes et les boucles de ligands autocrines/paracrines3.
Inhibiteurs de kinases approuvés pour une utilisation clinique
Vu le rôle majeur que joue le dérèglement de l’activité des protéines kinases dans la pathogenèse du cancer et d’autres maladies, les protéines kinases sont devenues une cible privilégiée pour le traitement3. Dans le domaine du traitement du cancer, le développement des inhibiteurs de kinases a été révolutionnaire, notamment avec des médicaments comme l’imatinib et l’erlotinib dont le succès clinique a été significatif. Ces inhibiteurs agissent généralement en bloquant le site de liaison à l’ATP de la kinase, empêchant ainsi l’enzyme de phosphoryler ses substrats3,10.L’inhibition bloque les canaux de signalisation qui régissent la croissance et la survie des cellules cancéreuses. La polyvalence des protéines kinases en tant que cibles médicamenteuses va au-delà de l’oncologie et inclut les maladies cardiovasculaires, inflammatoires et neurodégénératives9.
Cliquez ici pour accéder à des informations détaillées sur les inhibiteurs de kinases approuvés par la FDA au cours des deux dernières décennies >>.
SignalChem Biotech - qui fait maintenant partie de Sino Biological - propose des kinases de type sauvage et des kinases de type muté pour toutes les cibles primaires des médicaments contre les kinases approuvés par la FDA. Cela facilite le développement des inhibiteurs de kinases de nouvelle génération dotés d’une sélectivité améliorée et capables de surmonter la résistance aux médicaments. En savoir plus >>
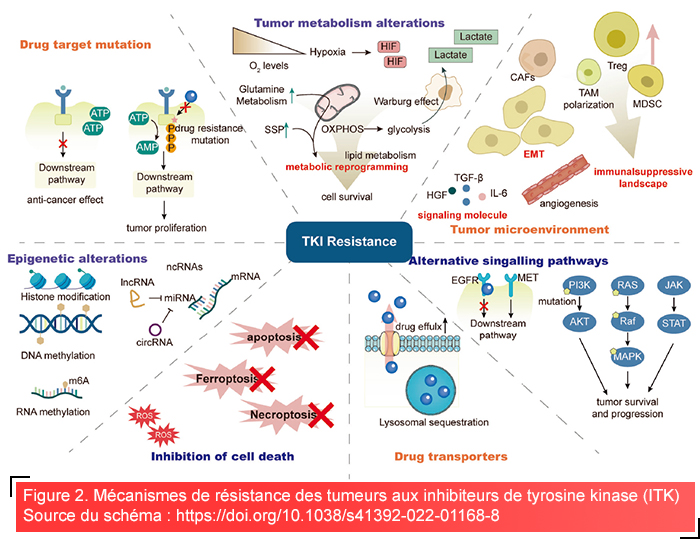
Les mutations ponctuelles dans le domaine de la kinase qui diminuent l’activité de l’inhibiteur constituent un mécanisme courant de résistance aux inhibiteurs de kinases. Ces mutations peuvent réduire l’affinité inhérente de l’inhibiteur pour la kinase cible, en éliminant des interactions critiques ou en induisant un changement de conformation de la kinase3,11. En outre, les mutations associées à la résistance peuvent augmenter l’affinité de la kinase pour l’ATP, ce qui dans ce cas peut réduire l’efficacité des inhibiteurs compétitifs de l’ATP.
Outre les mécanismes de résistance sur la cible, les cellules cancéreuses peuvent activer d’autres voies de signalisation pour contourner la kinase inhibée, ce qui constitue un mécanisme de résistance hors cible. Ce phénomène appelé « signalisation de contournement », permet aux cellules cancéreuses de continuer à se développer et survivre malgré la présence d’un inhibiteur12.Comprendre ces mécanismes est essentiel pour développer des inhibiteurs de nouvelle génération et des thérapies combinées capables de contourner la résistance et d’améliorer les résultats cliniques3,13.
La résistance des tumeurs aux inhibiteurs de tyrosine kinase est due à différents mécanismes. Le mécanisme direct concerne les mutations dans les cibles qui empêchent au médicament de se fixer. Les tumeurs réduisent également les niveaux intracellulaires d’inhibiteurs de kinases en augmentant l’efflux de médicaments ou la séquestration lysosomale. Le microenvironnement tumoral (TME) contribue à la croissance du cancer, induit une immunosuppression et favorise les changements adaptatifs des cellules tumorales tels que la reprogrammation métabolique et la transition épithélio-mésenchymateuse (EMT). Également, les tumeurs peuvent activer des voies de signalisation alternatives ou contourner la dépendance à l’égard des protéines kinases. La régulation épigénétique influence encore davantage ces mécanismes de résistance3.
Afin de soutenir les efforts ce compréhension des mécanismes de résistance aux TKI et de développer des solutions pertinentes pour y remédier, SignalChem Biotech (qui fait partie de Sino Biological) a développé un ensemble de tyrosine kinases mutantes qui englobent diverses mutations entraînant une résistance aux TKI. En savoir plus >>
Inhibiteurs de kinases de nouvelle génération
Les inhibiteurs de kinases de nouvelle génération sont conçus pour contrer les mécanismes de résistance grâce à plusieurs stratégies :
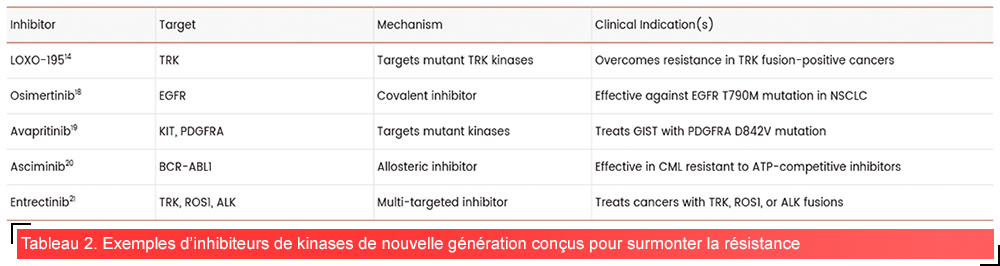
• Cibler les kinases mutantes : Ces composés sont spécialement développés pour inhiber les formes mutantes de kinases résistantes aux médicaments. Par exemple, LOXO-195 est un inhibiteur de TRK de nouvelle génération qui inhibe puissamment les mutations de résistance de TRK observées cliniquement, telles que TRKA-G595R, TRKA-G667C et TRKC-G623R14.
• Inhibiteurs allostériques : Contrairement aux inhibiteurs compétitifs classiques de l’ATP, les inhibiteurs allostériques se fixent à l’extérieur du domaine catalytique/site de liaison de l’ATP de la kinase cible, induisant un changement de conformation qui inhibe son activité. En tant que nouvelle génération de produits thérapeutiques, les inhibiteurs allostériques sont prometteurs, car ils ne sont pas affectés par les mutations courantes de résistance au site ATP2,15.
• Inhibiteurs covalents : Généralement, ces inhibiteurs forment des liaisons covalentes durables avec les résidus réactifs de la kinase (par exemple, les résidus nucléophiles tels que la cystéine ou la lysine), ce qui améliore l’affinité et la sélectivité de la liaison. Les inhibiteurs covalents ont un potentiel d’efficacité très élevé contre les kinases présentant des mutations spécifiques qui confèrent une résistance aux inhibiteurs de la génération précédente2,16.
• Thérapies combinées : La conception de combinaisons d’inhibiteurs de kinases, ainsi que la combinaison d’inhibiteurs de kinases avec d’autres modalités thérapeutiques, est une stratégie prometteuse pour surmonter et prévenir la résistance. La solution consiste à inhiber doublement la signalisation oncogène en ciblant plusieurs nœuds d’une voie, comme la combinaison des inhibiteurs de BRAF et de MEK pour retarder la résistance dans le mélanome malin17.
Les inhibiteurs de protéines kinases de nouvelle génération représentent une avancée majeure dans le traitement du cancer. Les essais cliniques ont donné des résultats prometteurs, en effet les inhibiteurs de nouvelle génération ont prouvé leur efficacité chez les patients ayant développé une résistance aux médicaments de la génération précédente6,18–21. En comblant les lacunes des inhibiteurs de kinases de première génération et en surmontant les mécanismes de résistance, ces nouveaux médicaments ont le potentiel d’améliorer les résultats pour les patients et d’offrir des solutions de traitement plus efficaces pour différents types de cancers.
Solutions pour le développement de médicaments à base de kinases
SignalChem Biotech (qui fait partie de Sino Biological) a développé l’une des plus larges gammes de kinases mutantes au monde afin de soutenir la recherche continue sur les mutations de kinases associées à la maladie, de comprendre les mécanismes de résistance acquise et d’identifier des inhibiteurs sélectifs des mutations. La production de ces kinases mutantes cliniquement référencées obéit à un contrôle qualité rigoureux qui permet de garantir une activité élevée et la reproductibilité des lots.
En tant que leader mondial dans la production de kinases et de tests d’activités, SignalChem Biotechest un acteur majeur dans tous les aspects de découverte de médicaments à base de kinases. Depuis plus de 20 ans, SignalChem Biotech soutient activement les chercheurs universitaires et industriels du monde entier en mettant à leur disposition la gamme la plus étendue de kinases hautement actives (plus de 700 kinases de type sauvage et plus de 400 de type muté), le développement d’enzymes et d’essais sur mesure, et en leur fournissant des services de criblage, et de profilage rapide des composés.
SignalChem Biotech se démarque par le niveau d’activité élevé de ses kinases, qui garantit des résultats fiables en matière de criblage et de profilage, combinée à une couverture étendue, englobant plus de 90% du kinome humain. Découvrez nos solutions pour le développement de médicaments à base de kinases >>
Références :
1. Min, H. Y. & Lee, H. Y. Molecular targeted therapy for anticancer treatment. Experimental and Molecular Medicine vol. 54 1670–1694 Preprint at https://doi.org/10.1038/s12276-022-00864-3 (2022).
2. Li, J. et al. Kinase Inhibitors and Kinase-Targeted Cancer Therapies: Recent Advances and Future Perspectives. International Journal of Molecular Sciences vol. 25 Preprint at https://doi.org/10.3390/ijms25105489 (2024).
3. Yang, Y., Li, S., Wang, Y., Zhao, Y. & Li, Q. Protein tyrosine kinase inhibitor resistance in malignant tumors: molecular mechanisms and future perspective. Signal Transduction and Targeted Therapy vol. 7 Preprint at https://doi.org/10.1038/s41392-022-01168-8 (2022).
4. Braun, T. P., Eide, C. A. & Druker, B. J. Response and Resistance to BCR-ABL1-Targeted Therapies. Cancer Cell vol. 37 530–542 Preprint at https://doi.org/10.1016/j.ccell.2020.03.006 (2020).
5. Cheng, H. C., Qi, R. Z., Paudel, H. & Zhu, H. J. Regulation and function of protein kinases and phosphatases. Enzyme Research vol. 2011 Preprint at https://doi.org/10.4061/2011/794089 (2011).
6. Bhullar, K. S. et al. Kinase-targeted cancer therapies: Progress, challenges and future directions. Molecular Cancer vol. 17 Preprint at https://doi.org/10.1186/s12943-018-0804-2 (2018).
7. Grant, S. K. Therapeutic Protein Kinase Inhibitors. Cellular and Molecular Life Sciences vol. 66 1163–1177 Preprint at https://doi.org/10.1007/s00018-008-8539-7 (2009).
8. Geraldes, P. & King, G. L. Activation of protein kinase C isoforms and its impact on diabetic complications. Circulation Research vol. 106 1319–1331 Preprint at https://doi.org/10.1161/CIRCRESAHA.110.217117 (2010).
9. Silnitsky, S., Rubin, S. J. S., Zerihun, M. & Qvit, N. An Update on Protein Kinases as Therapeutic Targets—Part I: Protein Kinase C Activation and Its Role in Cancer and Cardiovascular Diseases. International Journal of Molecular Sciences vol. 24 Preprint at https://doi.org/10.3390/ijms242417600 (2023).
10. Pottier, C. et al. Tyrosine kinase inhibitors in cancer: Breakthrough and challenges of targeted therapy. Cancers vol. 12 Preprint at https://doi.org/10.3390/cancers12030731 (2020).
11. Barouch-Bentov, R. & Sauer, K. Mechanisms of drug resistance in kinases. Expert Opinion on Investigational Drugs vol. 20 153–208 Preprint at https://doi.org/10.1517/13543784.2011.546344 (2011).
12. Lin, J. J. & Shaw, A. T. Resisting Resistance: Targeted Therapies in Lung Cancer. Trends in Cancer vol. 2 350–364 Preprint at https://doi.org/10.1016/j.trecan.2016.05.010 (2016).
13. De Santis, S. et al. Overcoming Resistance to Kinase Inhibitors: The Paradigm of Chronic Myeloid Leukemia. OncoTargets and Therapy vol. 15 103–116 Preprint at https://doi.org/10.2147/OTT.S289306 (2022).
14. Drilon, A. et al. A next-generation TRK kinase inhibitor overcomes acquired resistance to prior trk kinase inhibition in patients with TRK fusion-positive solid tumors. Cancer Discov 7, 963–972 (2017).
15. Schoepfer, J. et al. Discovery of Asciminib (ABL001), an Allosteric Inhibitor of the Tyrosine Kinase Activity of BCR-ABL1. J Med Chem 61, 8120–8135 (2018).
16. Ou, X., Gao, G., Habaz, I. A., & Wang, Y. Mechanisms of resistance to tyrosine kinase inhibitor-targeted therapy and overcoming strategies. MedComm, 5(9), e694. https://doi.org/10.1002/mco2.694 (2024).
17. Cohen, P., Cross, D. & Jänne, P.A. Kinase drug discovery 20 years after imatinib: progress and future directions. Nat Rev Drug Discov 20, 551–569. https://doi.org/10.1038/s41573-021-00195-4 (2021).
18. Leonetti, A. et al. Resistance mechanisms to osimertinib in EGFR-mutated non-small cell lung cancer. British Journal of Cancer vol. 121 725–737 Preprint at https://doi.org/10.1038/s41416-019-0573-8 (2019).
19. Teuber, A. et al. Avapritinib-based SAR studies unveil a binding pocket in KIT and PDGFRA. Nat Commun 15, (2024).
20. Réa, D. & Hughes, T. P. Development of asciminib, a novel allosteric inhibitor of BCR-ABL1. Critical Reviews in Oncology/Hematology vol. 171 Preprint at https://doi.org/10.1016/j.critrevonc.2022.103580 (2022).
21. Jiang, Q., Li, M., Li, H. & Chen, L. Entrectinib, a new multi-target inhibitor for cancer therapy. Biomedicine and Pharmacotherapy vol. 150 Preprint at https://doi.org/10.1016/j.biopha.2022.112974 (2022).